Лечение
Stenotrophomonas maltophilia
Burkholderia cepacia complex
Achromobacter xylosoxidans
Без применения триметоприм-сульфометаксозола
Перевод презентации Dr Iain Abbott
Infectious Diseases & Microbiology Advanced Trainee
Alfred Hospital, Melbourne
Август, 2013
Скачать оригинал публикации Некоторые проблемные грам-негативные неферментирующие бактерии (презентация)
Классификация
|
S. maltophilia Первоначально отнесена к роду Pseudomonas, затем к Xanthomonas, и затем классифицирована как Stenotrophomonas. |
B. cepacia complex — Относится к роду Pseudomonas. — Род состоит из, по крайней мере, 17 геномных вариантов. • После пересадки легких отмечается высокая смертность пациентов, инфицированных B. Cenocepacia
|
|
A. xylosoxidans — Изначально отнесена к роду Achromobacter, затем классифицирована как Alcaligenes, и впоследствии вновь отнесена кAchromobacter. — Род включает 6 видов бактерий. — Ближайший родственник Bordetella.
|
Эпидемиология и пути заражения
- Повсеместно встречаются в природе (Найдены в воде, в почве, в ризосфере, в и на растениях
- Распространены во всем мире
- Онкологические пациенты (MDACC1)
- S. Maltophilia занимает пятое место в списке наиболее часто изолируемых грамм-негативных бактерий
(встречаемость увеличилась с 2% в 1986 году до 7% в 2002 году) - Бактериемия в Тропической Австралии (2000-2010; n= 4536)2
-S. Maltophilia : 74 (1.6%)
-B. Cepacia – не упоминается
— Achromobacter spp.: 10 (0.2%)
- В отличие от B. Cepacia комплекса, пути заражения пациентов S. Maltophilia и А. xylosoxidans не уточняются.
— В некоторых случаях сообщается, что имела место перекрестная передача инфекции между пациентами 3,4
1. CID (2007) 45;1602-9
2. Diag Micro Infect Dis (2013) 75;266-270
3. Eur J Clin Microbiol Infect Dis (2011) 30:973 –980
4 Int J Hygiene Environ Health (2009) 212:330-337
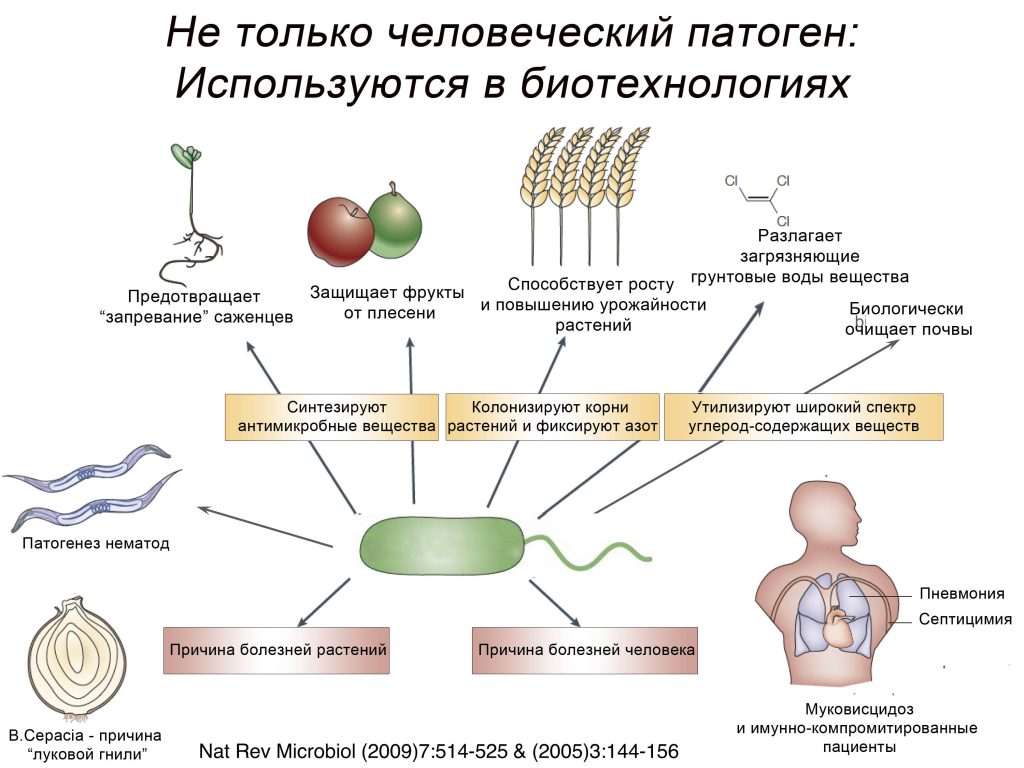
B. cepacia – причина «луковой гнили».
Эпифитные бактерии Stenotrophomonas бактерий может также изменить свойства поверхности листьев, на которых они обитают. Schreiber с соавторами продемонстрировали, что С. Maltophilia может увеличить проницаемость для воды кутикулы лавровишни, что, в свою очередь должно увеличить наличие воды и растворенных соединений в филлосфере (среде на поверхности листьев, где обитают бактерии), тем самым улучшая экологические условия роста бактерий. Молекулярный механизм ( или механизмы ), ответственные за наблюдаемые эффекты , пока неизвестны, однако , было предложено что за этот процесс могут быть ответственны внеклеточные ферменты, которые разрушают полимеры листьев (Nat Rev Microbiol (2009) 7:514-525)
С. maltophilia также могут быть способны защищать себя от простейших, которые обитают в почве и питаются бактериями, что дает этим бактериям дополнительное преимущество перед другими бактериями. Геном изолированных из внешней среды С. maltophilia R551 -3 содержит кластер из шесть генов ( Stemr_2139 -44) , который отсутствует у С. maltophilia вида K279a. rebA–C гены кодируют так называемые R-тельца (в цитоплазме бактерий), которые являются токсичными для чувствительных видов Paramecium, рода одноклеточных простейших инфузории , которые живут в пресноводной среде.
Подобные rebA–C и rebB кластеры генов найдены у Xanthomonas axonopodis и Shewanella denitrificans, эти белки могут играть роль в защите бактерий от хищных простейших, обитающих в ризосфере.
Использование в биотехнологиях Stenotrophomonas SPP является перспективным для сельского хозяйства, применение Stenotrophomonas SPP . может привести к повышению урожайности культур и может улучшить рост растений на низкокачественных почвах. Например, наблюдали до 180% улучшения роста пшеницы, помидор, салата, сладкого переца, дынь , сельдерея и моркови в сильно засоленных почвах Узбекистана. Применение Stenotrophomonas SPP . также перспективно для биоремедиации и фиторемедиации (био- и фито-очистке) почв, так как эти бактерии могут метаболизировать широкий спектр органических соединений , присутствующих в ризосфере, в том числе фенольных соединений, которые содержатся в экссудате корней растений. С. maltophilia может разлагать паранитрофенол и хлорфенол, полициклические ароматические гидрокарбонатные производные селена, бензол, толуол, этилбензен и ксенобиотики. Эти широкие метаболическими способности могли бы обеспечить защиту растений от фитотоксического эффекта этих соединений. Stenotrophomonas SPP.
может повысить продуктивность растений несколькими путями, включая синтез гормона роста растений -индол- 3-уксусной кислоты (МАА), путем фиксации азота, и окисления элементарной серы, которое, в свою очередь, обеспечивает сульфат для растений.

Клиническое значение
- Не опасна для здоровых
- Важный патоген для
— пациентов с муковисцидозом
— пациентов с ослабленным иммунитетом
- Внутрибольничные инфекции из загрязненной окружающей среды
— Лекарственные препараты, небулайзеры, диализная жижкость, солевые растворы, дезинфекторы, жидкость для контактных линз
- Может быть причиной различных заболеваний
-Бактериемия, пневмония, менингит, инфекции мочевыводящей системы и др.
- Может продуцировать биопленки и выживать внутри них
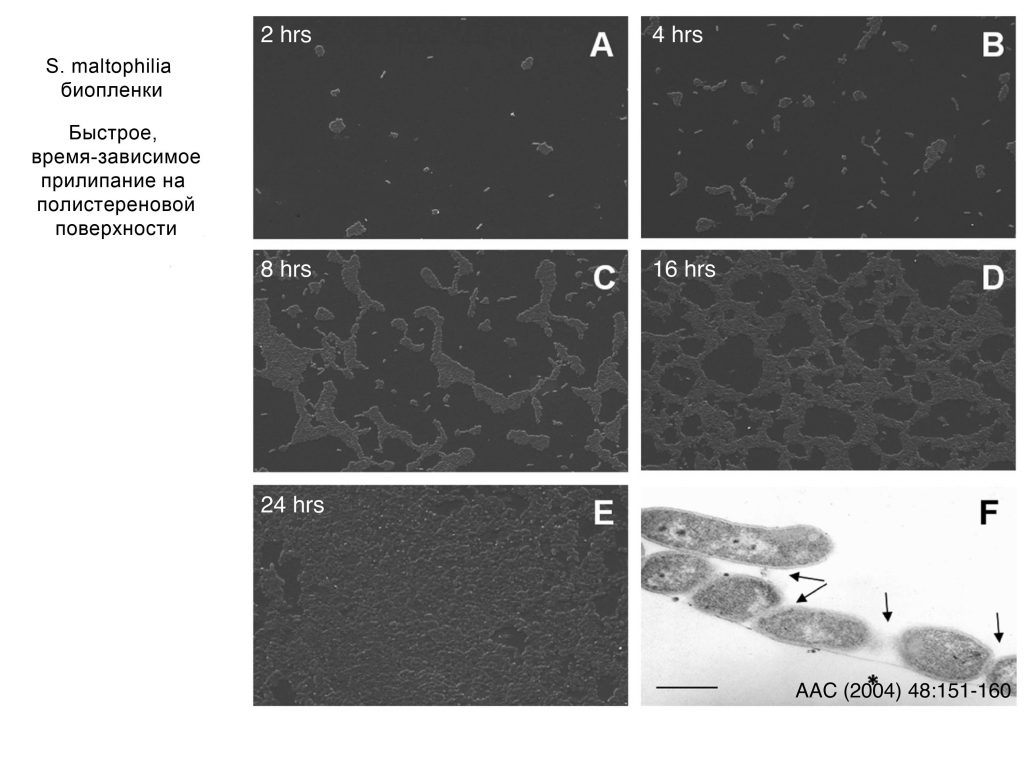
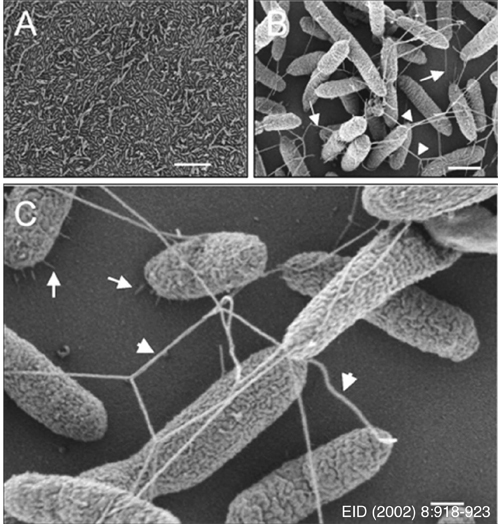
Ультраструктурный анализ Stenotrophomonas maltophilia на пластиковой поверхности.
- В сканирующем электронном микроскопе показана прочная адгезия штамма SMDP92 к пластиковой поверхности.
- (B) структуры, напоминающие жгутики, кажется, торчат и соединяют бактерии между собой и бактерии и пластик
- В дополнение жгутикоподобным нитям при высоком разрешении видны тонкие фибриллярные структуры, с помощью которых бактерии прикрепляются к небиологической поверхности
Муковисцидоз
| • Традиционные постоянно встречаемые бактерии при МВ
P. aeruginosa : 60 -80% MSSA: 30 –60% • Снижение заболеваемости B. cepacia complex: 3–5% • Увеличение заболеваемости S. maltophilia: 4–15% A. xylosoxidans: 3–8% Нетуберкулезные микобактерии: 5 –13% MRSA: 17.2% (в США) |
• Франция, региональный центр МВ
5315 образцов мокроты, 300 пациентов P. aeruginosa: 59% S. maltophilia: 18.9% B. cenocepacia : 13.8% A. xylosoxidans : 6.9% – Обычные коинфекции • B.cepacia в Австралии и Новой Зеландии 116 зараженных пациентов B . multivorans : 29.3% • B. Cenocepacia : 45.7% Не зафиксировано перекрестной передачи |
| J Cyst Fibro (2009) 8;386-391
JAC (2010) 65;1853-1861 |
Eur J Clin Micro Infect Dis (2011) 30:973 -980
Res Micro (2008) 159;194-199 |
Колонизация синегнойной палочкой или золотистым стафилококком в период между 1985 и 2005 остаются стабильными
(От 77 до 82%, р = 0,159; 54 до 47%, р = 0,108, соответственно).
Снижается заболеваем.негнойной палочки встречается в 9,6% -19,2% случаев, среди B.Cepacia — в 70,3%, А. xylosoxidans в 37,3% и С. maltophilia в 27,4% случаев.
Микробиология
| • Аэробные
• Неферментирующие грамм-негативные бактерии • Подвижные • Каталаза-позитивные • Оксидаза-позитивные • Индол-негативные • H2S негативные • Уреаза-негативные
|
• Потенциально все могут быть неверно идентифицированы
Pseudomonas spp. Автоматическая идентификация на оборудовании: — слабое или нетоное определение — Трудности с образцами, полученными от МВ-пациентов MALDI -TOF MS — Опубликованные отчеты свидетельствуют о качественных результатах идентификации всех трех организмов, включая изолированных от МВ-пациентов
JCM (2001) 39;3942-3945
|
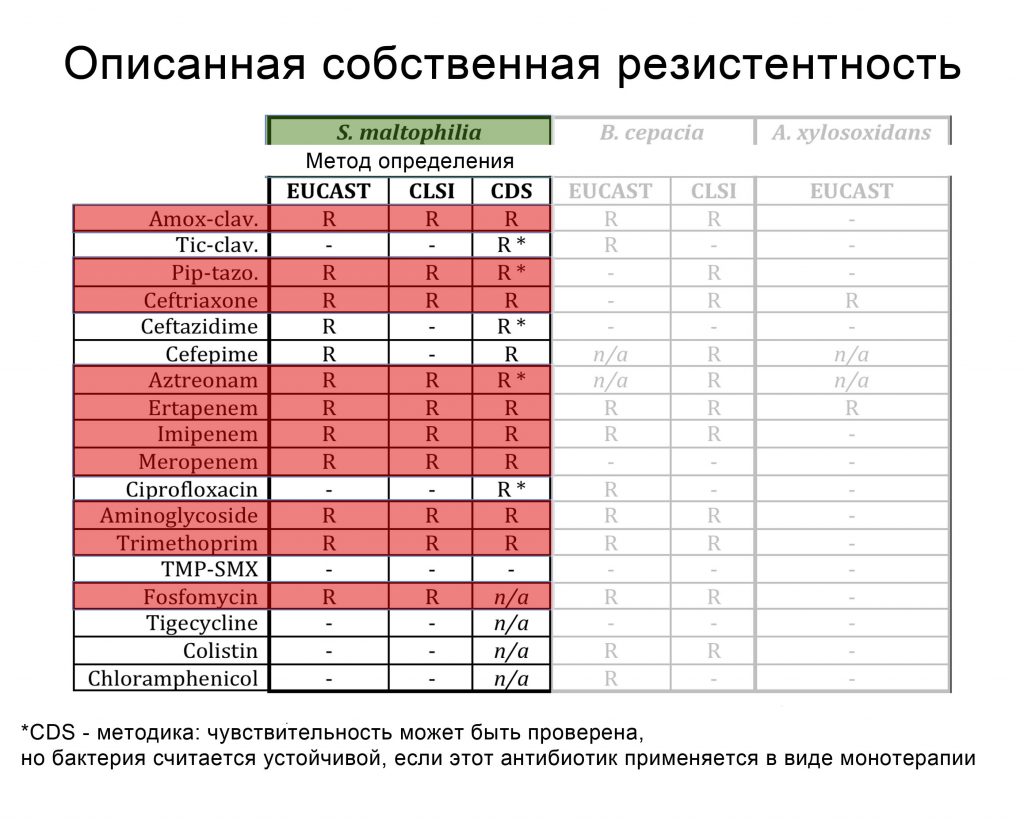
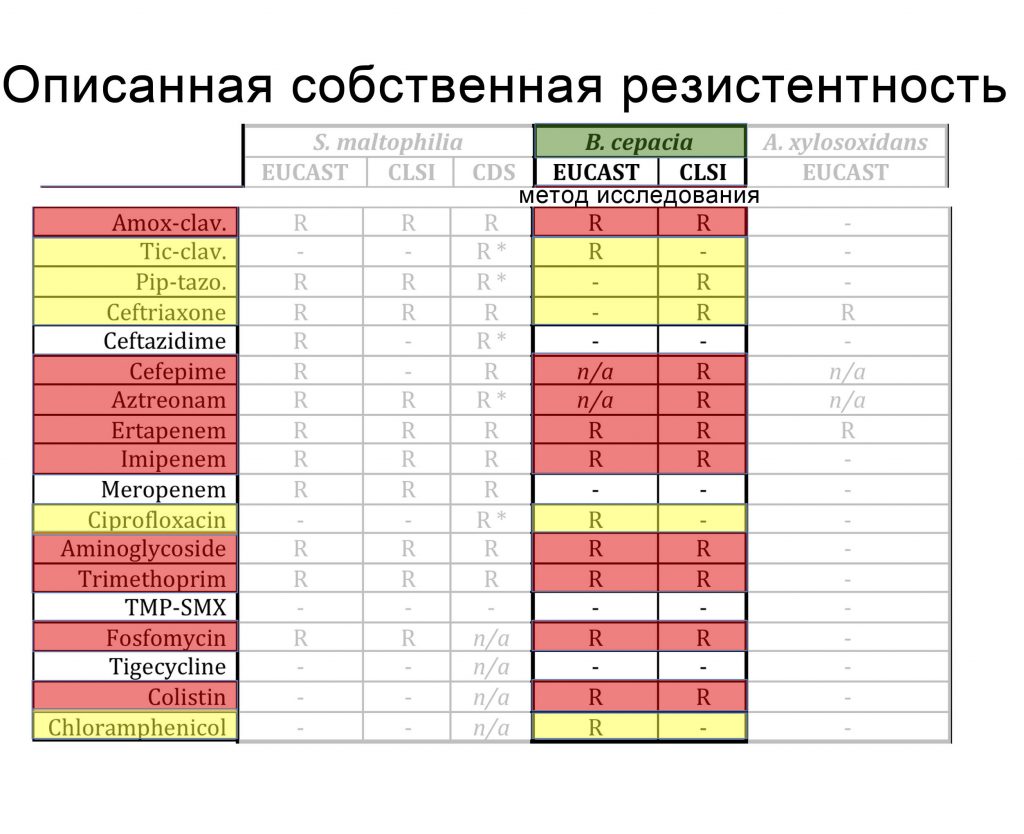
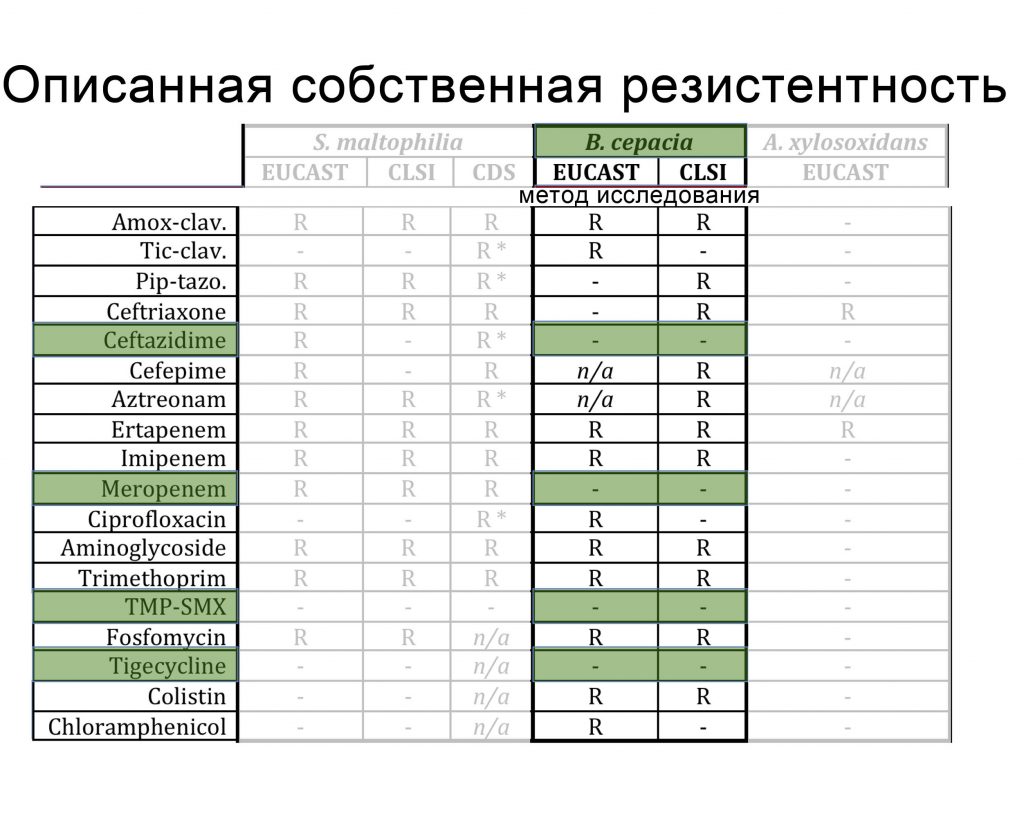
 From Ref: AAC (1998)32:276-278. JCM (2005)38:194-199. IJAA (2009)34:111-120. AAC (2013)57:603-605
From Ref: AAC (1998)32:276-278. JCM (2005)38:194-199. IJAA (2009)34:111-120. AAC (2013)57:603-605
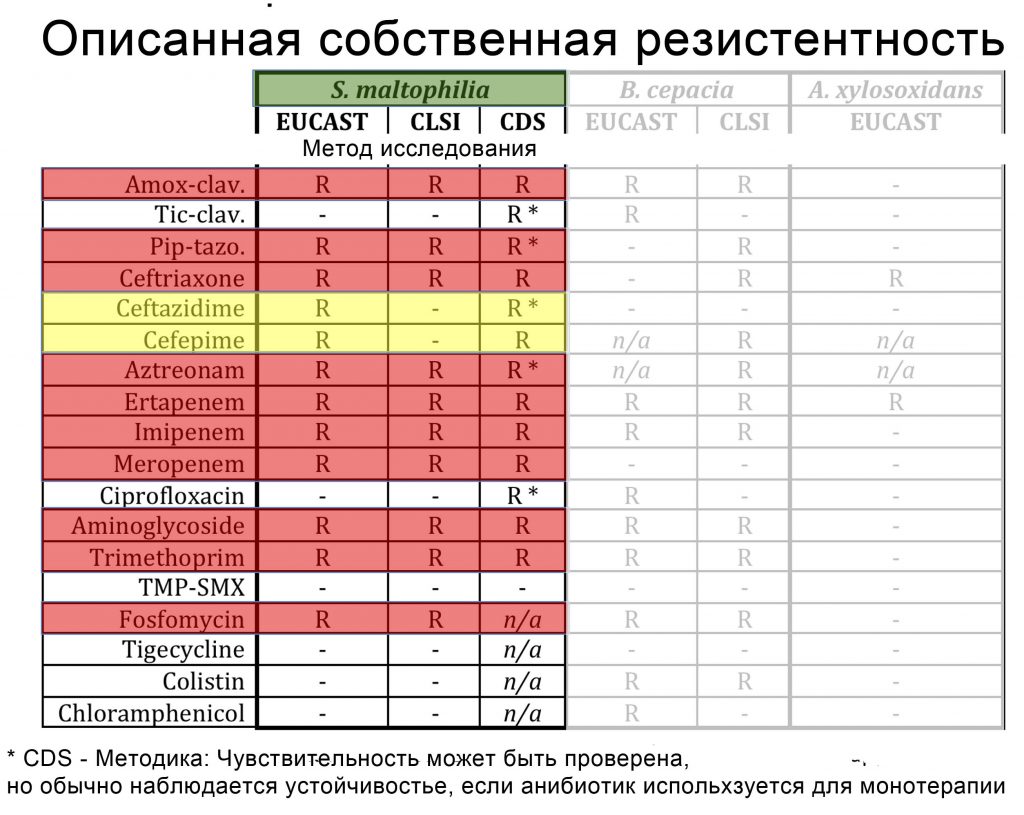
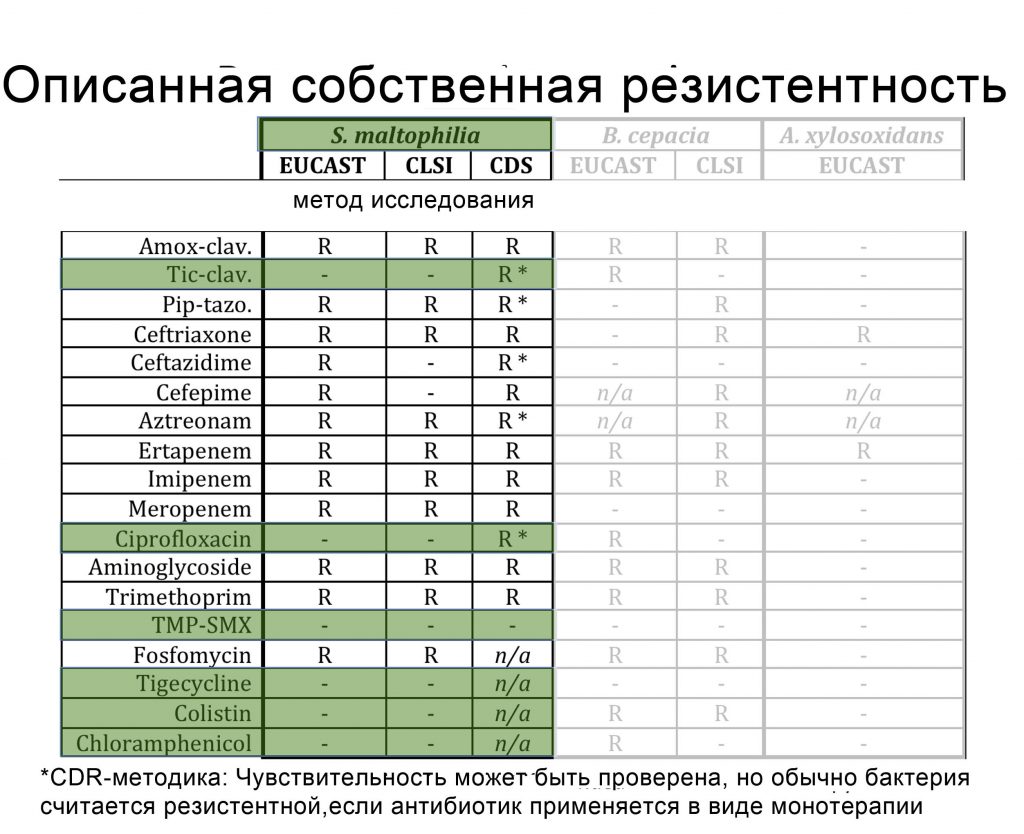
S. maltophilia: Механизмы резистентности
| Категория | Механизм резистентности | На какие антимикробные препараты воздействует |
| Бета-лактамазы | Два типа хромосомно-индуцируемых
β-лактамаз : -L1 (класс B) MBL; L2 (класс A) серин Плазмида ESBL -TEM-2 пенницилиназа; CTX-M |
Гидролиз всех β-лактамов
|
| Эффлюкс-системы | Мультилекарственные эффлюкс-системы —
SmeDEF; SmeABC; SmrA |
Резистенность к тетрациклинам, хлорамфениколу, эритромицину и фторхинолонам |
| Ферментные модификации | Аминогликозид-модифицирующие ферменты | Резистентность к аминогликозидам |
| Изменения в наружной мембране | Фосфоглюкомутазы (SpgM) | Аминогликозиды, полимиксин В, фторхинолоны |
| Направленные модификации генома | Защита ДНК-гиразы и топоизомеразы (Smgnr); Класс 1 интегронов (Sul1 & Sul2) |
Резистентность к фторхинолонам и триметоприм-сульфометоксазону |
S. maltophilia: Чувствительность к антимикробным препаратам.
| Антибиотик | Чувствительность InVitro | Детали |
| Триметоприм-сульфаметоксазол | >90%
|
Бактериостатик. Необходимы высокие дозы (ТМП>=15 мг/кг).
Более низкая чувствительность наблюдается у пациентов с МВ
|
| Тикарциллин + Клавулановая кислота | От 45.3 до >70% | Бактериостатик.
Клавулановая кислота ингибирует acid inhibits L2 β-лактамазы. Сообщается также об эффективности комбинации Азтреонам + КК |
| Новые фторхинолоны (например, моксифлоксацин) | От 85 до >95% | Бактерицидное действие. Улучшает эффективность ципрофлоксацина. Наблюдается эффективность и после приема антибиотиков, эффективен в отношении биопленок. |
| Производные тетрациклина (миноциклин, тигециклин) | От 66,7 до 100% | Небольшой опыт клинического применения. Чувствительность может быть переоценена |
| Колистин | От 62,5 до 79% | Переменная активность. Неверная оценка чувствительность может быть произведена при применении методики Etest. |
| Цефтазидим | 0-53% | Наблюдается некторая активность in vitro. Клинический успех может быть достигнут при применении в комбинации с другими антибиотиками. |
| Хлорамфеникол | 11,5-81,5% | Некоторая активность in vitro |
Exp Rv Anti Infect Ther (2011) 9:471-488
Micro Drug Res (2012) 18;396-401
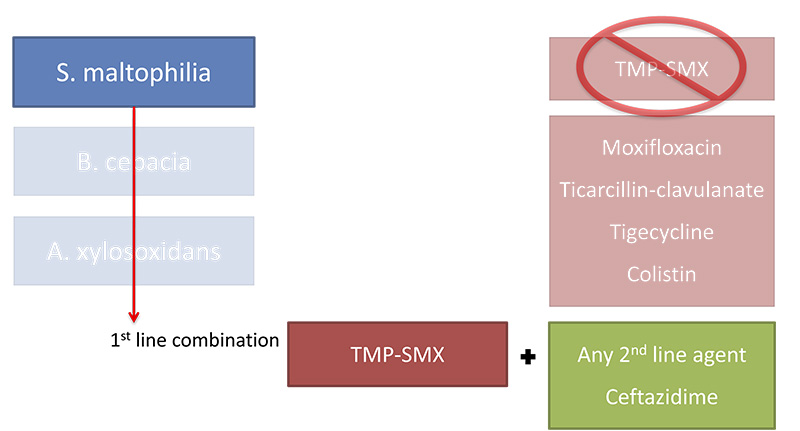
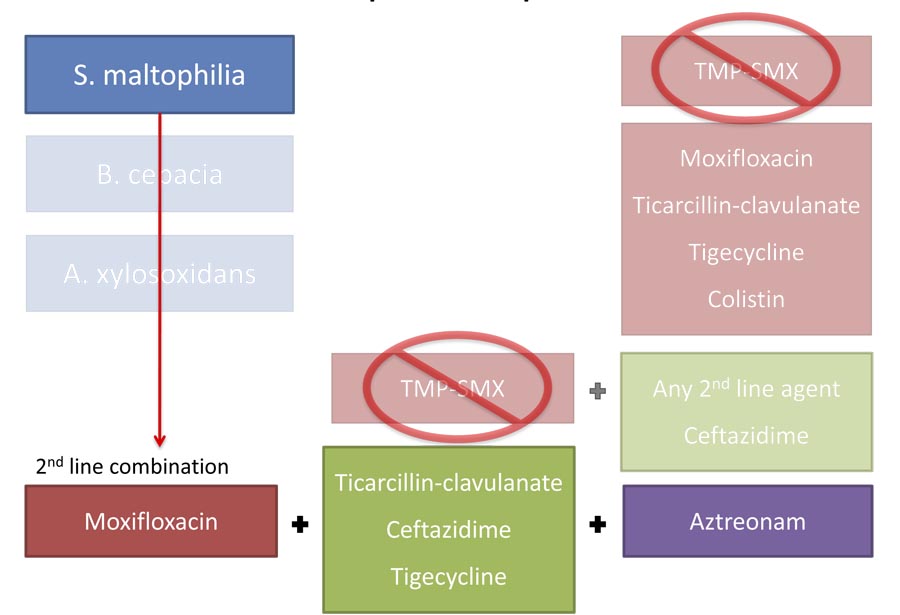
S. maltophilia: Взаимодействие антибиотиков
Комбинации антибиотиков значительно более эффективны, чем монотерапия при in vitro моделировании инфекционного процесса с Stenotrophomonas maltophilia
Антимикробная чувствительность Stenotrophomonas maltophilia и синергия антибиотиков исследовалась в изолятах, полученных от пациентов с МВ
Наблюдается синергия при сочетаниях колистина, рифампицина и триметоприм / сульфаметоксазола при воздействии на бактерии с множественной лекарственной устойчивостью
| • In vitro фармакодинамическая инфекционная модель
— Триметоприм-сульфаметоксазол + цефтазидим + ципро + гентамицин + тобрамицин |
• Единичные случаи / серии наблюдений
— Триметоприм-сульфаметоксазол + цефтазидим + ципро + амикацин + тобрамицин — Триметоприм-сульфаметоксазол+ Тикарциллин- Клавулановая кислота и азтреонам |
| • Анализ времени гибели бактерий
— Левофлоксацин + меропенем |
• Без Триметоприм-сульфаметоксазола
— Ципро+ Тикарциллин- Клавулановая кислота+цефтазидим |
| • In vitro изучение
— Триметоприм-сульфаметоксазол + колистин — Колистин + рифамицин |
|
| • Изучение у пациентов с МВ, in-vitro взаимодействие
— Триметоприм-сульфаметоксазол + Тикарциллин- Клавулановая кислота + пиперациллин-тазобактам — Ципро+ Тикарциллин- Клавулановая кислота+ пиперациллин-тазобактам — Доксициклин+ Тикарциллин- Клавулановая кислота |
Diag Micro Infect Dis (2005) 51;39-43
Diag Micro Infect Dis (2010) 67;297 -300
Diag Micro Infect Dis (2002) 44;259-263
AAC (2004) 48;168-171BMT (2010) 45;1109-1110
JAC (2008) 62:889-894
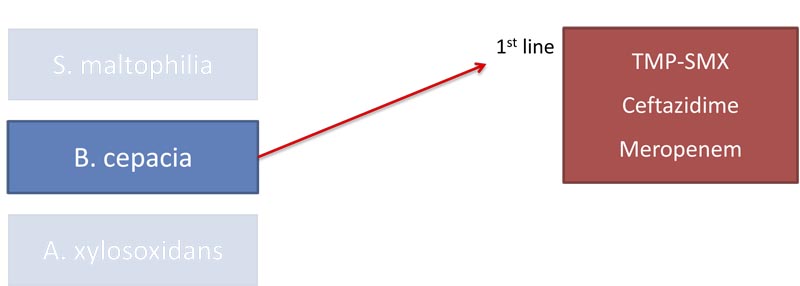
B.Cepacia Механизмы резистентности
| Категория | Механизм резистентности | На какие антимикробные препараты воздействует |
| Бета-лактамазы | Хромосомный, индуцируемый класс
Ambler class C (PenA); и другие (Ambler class A + D)
|
β-лактамы
|
| Эффлюкс-системы | RND family efflux transporter (активный отток токсичных веществ и антибиотиков из клетки, бактерии выкачивают токсичные для них вещества с помощью специальных клеточных насосов – WIKI, прим. перев.) | Аминогликозиды, ципрофлоксацин, триметоприм, хлорамфеникол |
| Ферментные модификации | Аминогликозид-модифицирующие ферменты, дегидрофолат редуктазы | Резистенность к аминогликозидам, триметроприму |
| Изменения в наружной мембране | Непроницаемость клеточной стенки | |
| Направленные модификации генома | Изменения в пенициллин-связывающих протеинах, мутации в области, ответственной за устойчивость к хинолонам (gyrA & parC)
|
Резистентность к фторхинолонам и триметоприм-сульфометоксазону |
AAC (2008) 52;1201-1203
J Biol Chem (2013) 28;19090-102
J BiolChem (2013) 28;19090-102
Nat Rev Microbiol (2005) 3:144 -156
J Med Microbiol (2010) 59;679-689
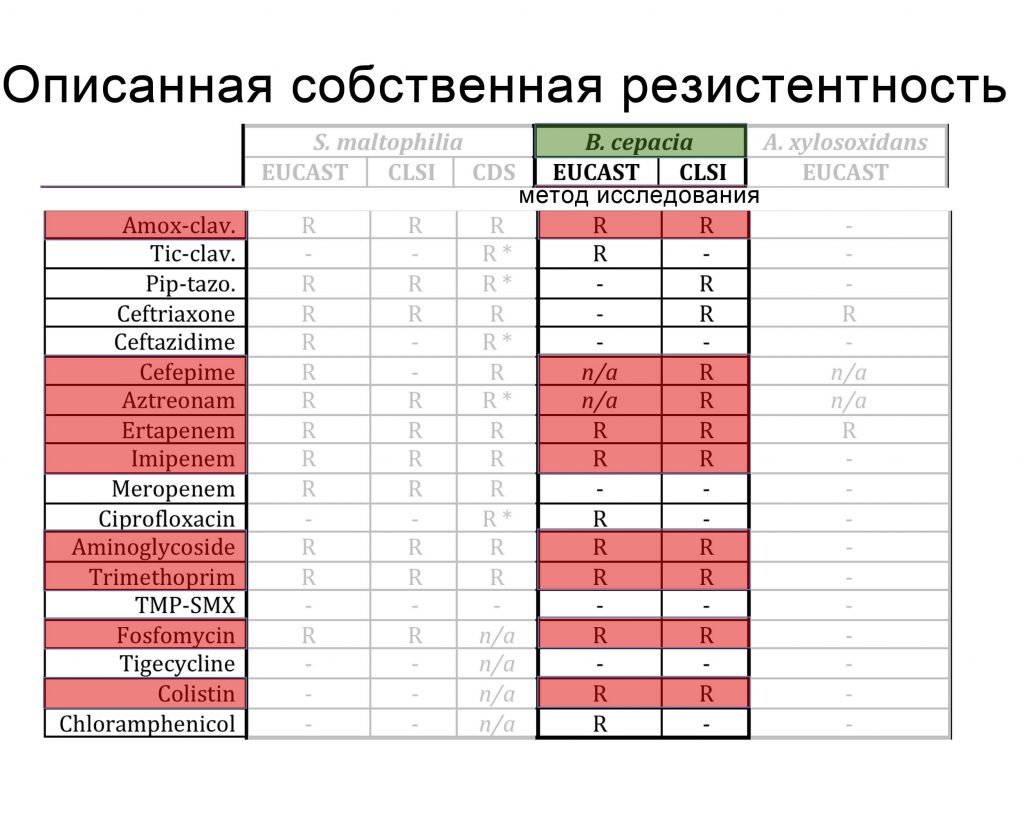
B. Cepacia: Чувствительность к антимикробным препаратам
| Антибиотик | Чувствительность InVitro | Детали |
| Триметоприм-сульфаметоксазол | 0-90,7%
|
Наблюдается рост резистентности у МВ пациентов |
| Цефтазидим | От 23 до >97,3% | К другим цефалоспаринам наблюдается резистентность |
| Тикарциллин + Клавулановая кислота
Пиперациллин — тазобктам |
От 15,6 до >97,3% | Чувствительность различна для различных лекарств. Нет точных данных о резистентности к тазобактаму |
| Меропенем | От 26 до 100% | Минимальная активность имипенема+дорипенема |
| Колистин | От 62,5 до 79% | Переменная активность. Неверная оценка чувствительность может быть произведена при применении методики Etest. |
| Фторхинолоны | 5,5-71,4% | Минимальная активность, легко развивается резистентность |
| Хлорамфеникол | 11,5-81,5% | Некоторая активность in vitro |
| Моноциклин, тигециклин | 5,5-44,4% | Нет точных данных по чувствительности к тигециклину. Минимальная ингибирующая доза (90) = 4 |
J Micro Immunol Infect (2001) 34;215-9
Int J Antmicrob Agents (2005) 25;95-109
AAC (2007) 51:1085-88
Microb Drug res (2012) 18;296-201
Int J Antimicrob Agent (2009) 33;394-404
Diag Micro Infect Dis (2011) 70;260-266
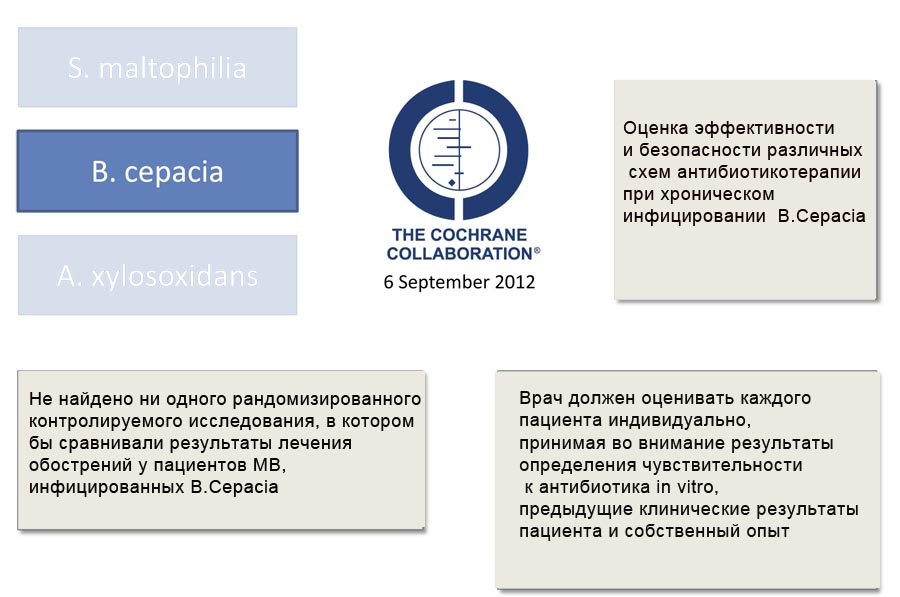
B. Cepacia: Взаимодействие антибиотиков
- Спорные данные
- По данным Gibson et al (Am J Resp Crit Care 2003)
— 57% изолятов не чувствительны к комбинациям
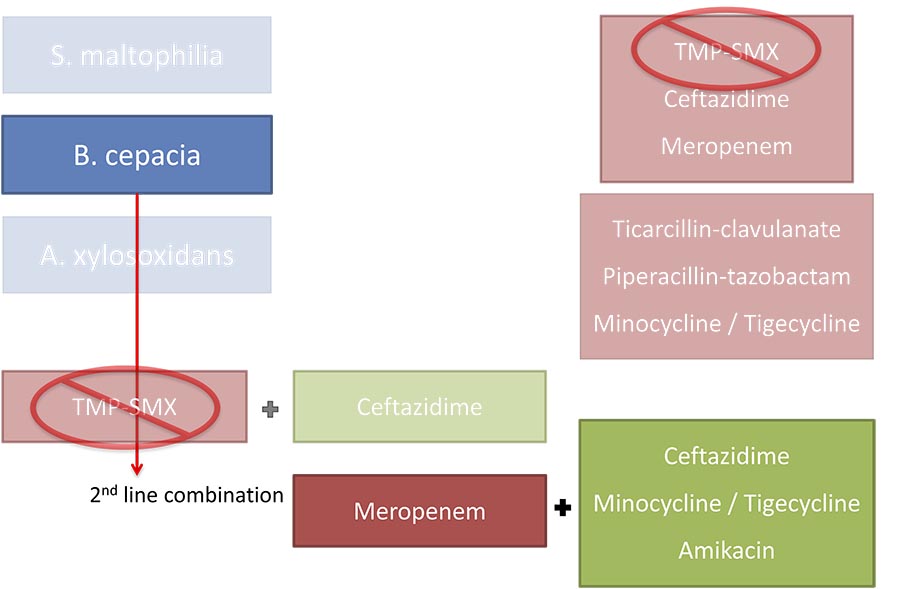
— Наиболее активные комбинации Меропенема, плюс, по крайней мере, один из следующих антибиотиков: миноциклин, амикацин, цефтазидим
— Рекомендуется лабораторная проверка чувствительности
- По данным Aaron et al (Lancet 2005)
Проведено рандомизированное, двойное слепое клиническое исследование. Показано, что комбинированная терапия антибиотиками не улучшала бактериологических и клинических результатов.
- По данным Zhou et al (AAC 2007)
— Наиболее активна комбинация миноциклина, меропенема и цефтазидима
— синегрия антибиотиков наблюдается редко
Протестировано 2621 штаммов Burkholderia cepacia, изолированных от 1257 больных муковисцидозом. Миноциклин , меропенем и цефтазидим были самыми активными, ингибирование достиагалось в 38 %, 26% , и 23 % штаммов соответственно. Синергия отмечалась редко (в диапазоне от 1 % до 15 % штаммов на комбинацию антибиотиков)
В работе Gibson RL et.al (Am J Respir Crit Care Med 2003;168:918–25 исследовали совместное действие антибиотиков, использовали две комбинации препаратов. Обнаружено, что 57% изолятов были резистентны ко всем исследуемым комбинациям. Наиболее эффективны были комбинации моноциклина и хлорамфеникола (чувствительны 49% изолятов), и хлорамфеникола с цефтазидимом (26% изолятов чувствительны). Множественные комбинации лекарств также были исследованы. Установлено, что для всех изолятов может быть найдена одна, две или три комбинации лекарств, к которым они имеют чувствительность. Наиболее активные комбинации представлены в следующей таблице. Большинство активных комбинаций включают меропенем. К сожалению, не было возможности предсказать,Таким образом, при подборе терапии необходимы предварительные исследования комбинаций препаратов in vitro.
В исследовании Huang CH et.al (J Microbiol Immunol Infect 2001;34:215–9) показано, что хинолоны обладают переменной активностью, и к ним легко развивается резистентность.
Только в одном рандомизированном контролируемом исследовании было проведено изучение вопроса о том, действительно ли результаты лечения при обострении МВ будут лучше, если определять чувствительность к комбинации антибиотиков и выбирать лучшую комбинацию, чем определять чувствительность раздельно к каждому антибиотику. Результаты этого клинического исследования были неутешительными: лечение, основанное на применении антибиотиков, к которым определена чувствительность в комбинации были не лучше, чем при применении антибиотиков, к которым чувствительность определялась традиционным раздельным способом.
Исследование чувствительность к комбинации антибиотиков у пациентов с МВ в качестве рутинного метода может быть дорогостоящим, и может не быть полезным, так как нет четких доказательств того, что регулярное проведение тестов на чувствительность к комбинации препаратов улучшит клинические результаты лечения.
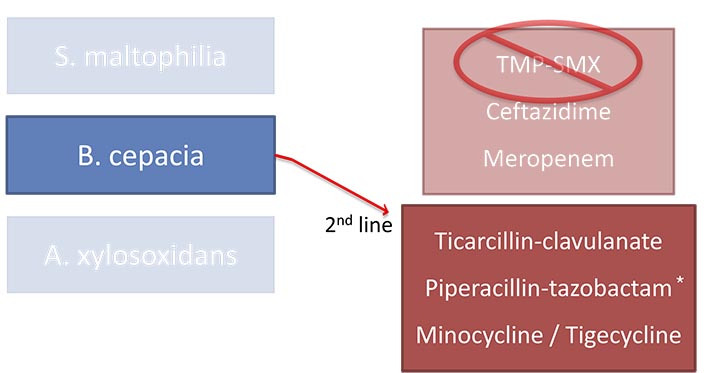
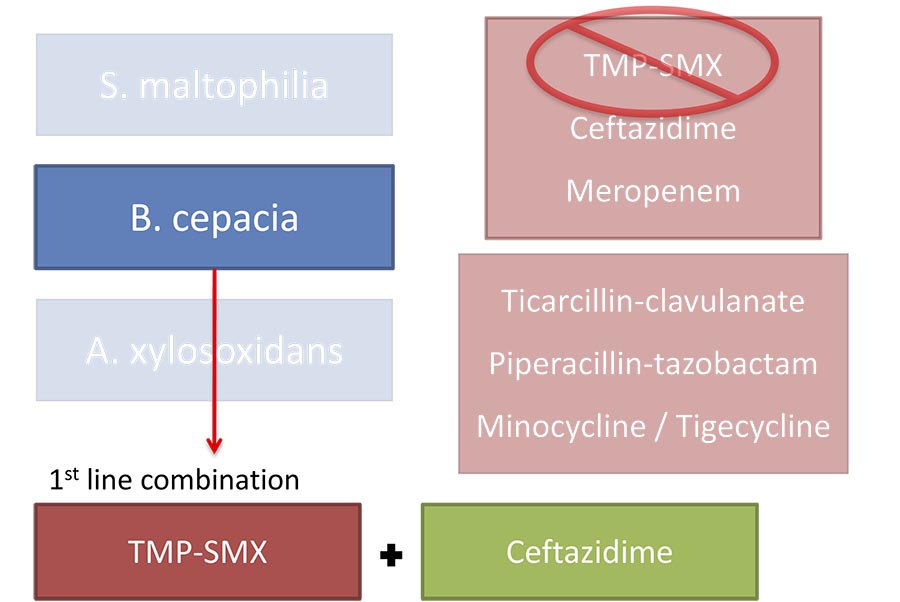
Цефтазидим, меропенем и пенициллины, главным образом пиперациллин, каждый в отдельности или в комбинации, могут применяться как альтернативная схема лечения, в которой не используется ко-тримоксазол.
lancet (2005) 366:463–71
AAC (2007) 51:1085-88
Am J Resp Crit Care Med (2003) 168:918-25
A.xylosoxidans Механизмы резистентности
|
Категория |
Механизм резистентности |
На какие антимикробные препараты воздействует |
| Бета-лактамазы | Оксациллиназы OXA114, OXA243 OXA2
Цефалоспориназы |
β-лактамы
|
| Эффлюкс-системы | Мультилекарственный эффлюкс-насос РНК-типа
AxyABM (выводит цефалоспорины из клетки) и AxyXY – OprZ (обеспечивает устойчивость к карбапенемам) |
Уменьшается минимальная ингибирующая концентрация цефалоспоринов (кроме цефепима), азтреонама, фторхинолонов, хлорамфеникола. Изначальная устойчивость к аминогликозидам, удаление цефепима из клетки, карбапенемов, некоторых фторхинолонов, тетрациклинов и эритромицина |
| Ферментные модификации | Аминогликозид-модифицирующие ферменты, AAC(6’) — Ib and aadA1 | Аминогликозиды |
J Cystic Fibrosis (2013) 12;170-176
AAC (2013) 57;603-605
AAC (2011) 55;4912-4914
Curr Microbiol (2012) 65;673-678
A.xylosoxidans Антимикробная чувствительность
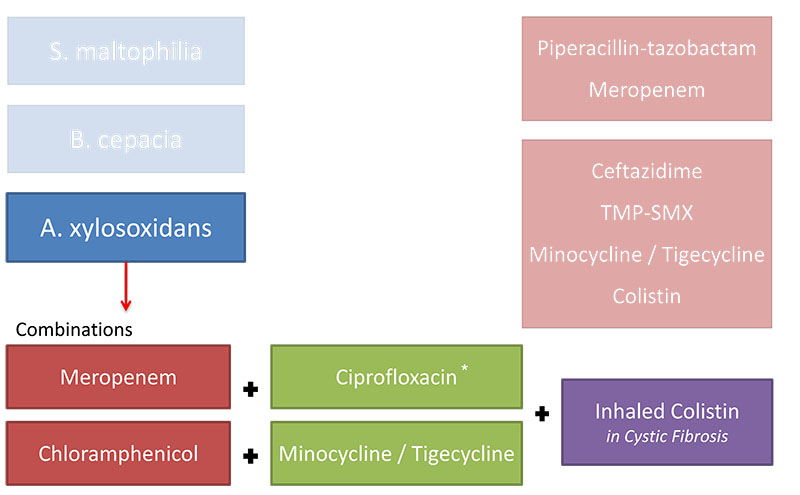
Отмечается некоторая синергия антимикробных средств, включая комбинации хлорамфеникола-миноциклина (активность в 35% случаев), ципрофлоксацина-имипенема (27%) и ципрофлоксацина-меропенема (23%).
| Антибиотик | Чувствительность InVitro |
| Триметоприм-сульфаметоксазол | 0-92% |
| Цефтазидим (к другим цефалоспоринам, включая цефепим – резистентность) | От 45 до >84,7% |
| Тикарциллин + Клавулановая кислота
Пиперациллин — тазобктам |
От 40 до 100% |
| Карбапенемы | От 52 до 100% |
| Колистин | От 28 до 70,1% |
| Фторхинолоны | 0-40% |
| Хлорамфеникол | 22% |
| Моноциклин, тигециклин | 44-51% |
AAC (1988) 32;276-278
JCM (2001) 39;3942-3945
JAC (2004) 54;1057-1061
Int J Antmicrob Agents (2005) 25;95-109
Diag Micro Infect Dis (2005) 51;215-218
J Micro ImmunolIn fect (2005) 38;194-199
Microb Drug Res (2012) 18;396-401
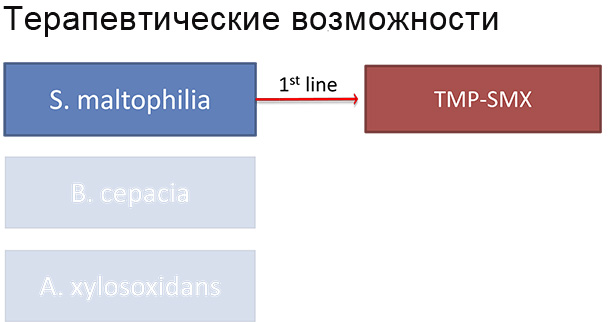
(TMP-SMX — триметоприм-сульфаметаксозол)
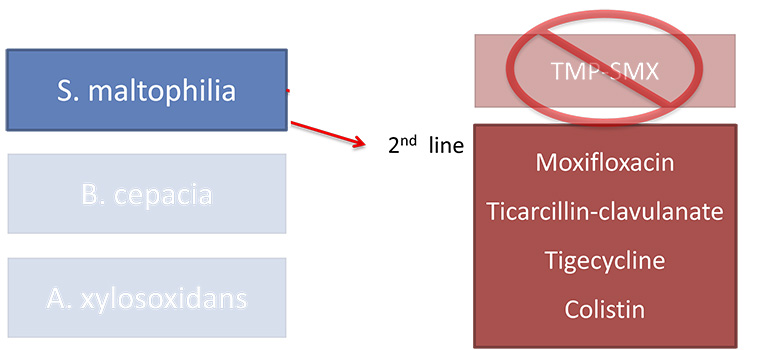
.
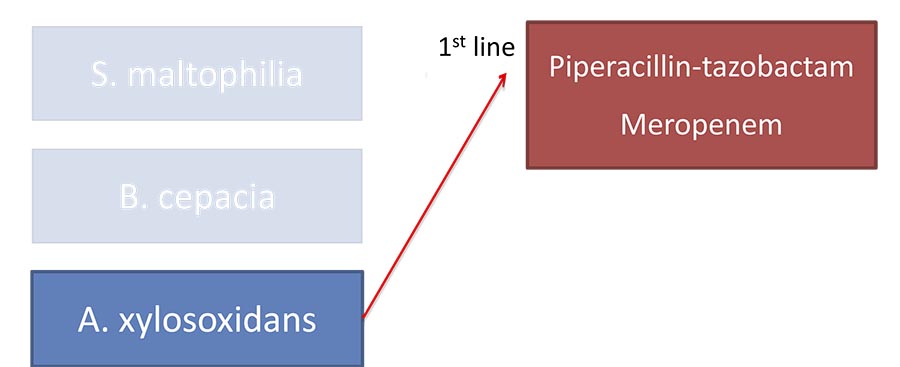
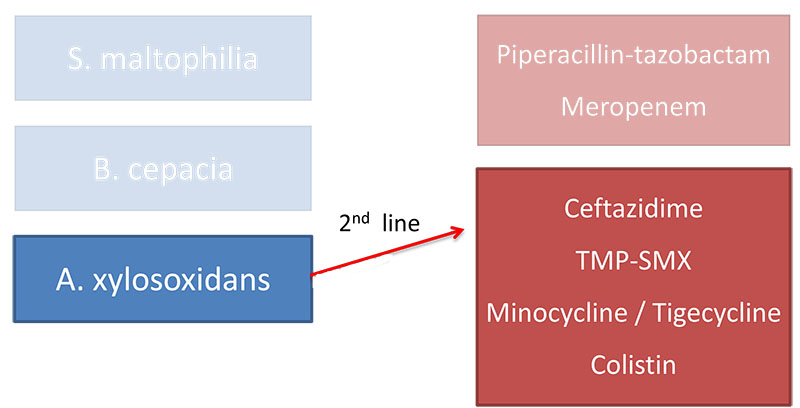
Пиперациллин, пиперациллин-тазобактам и карбапенем наиболее эффективны против А. xylosoxidans.
Профиль чувствительности Achromobacter SPP к противомикробным препаратам показывает, что эта бактерия часто мультирезистентна, в том числе к фторхинолонам, аминогликозидам и к большинству лактамных антибиотиков широкого спектра действия. Поэтому лечение этой инфекции должно проводиться с учетом ее чувствительности к антибиотикам в каждом отдельном случае.
Некоторые авторы считают, что при серьезных инфекциях необходима комбинированная терапия, и что при исследованиях in vitro наблюдали синергизм или аддитивное действие для комбинации пиперациллина-гентамицина, хлорамфеникола-миноциклина и ципрофлоксацина-имипенема
Заключение
- S. maltophilia, B.cepacia и A.xylosoxidans удивительные организмы, которые могут успешно жить в агрессивных средах
— В том числе выдерживать лечение антибиотиками - Широкое применение фторхинолонов, аминогликозидов и бета-лактамов широкого спектра действия создало идеальную свободную экологическую нишу для этих условно-патогенных микроорганизмов
- Совместное инфицирование с Pesudomonas, межвидовые взаимодействия и существование внутри биопленок создало уникальные терапевтические проблемы
- Для успешного лечения этих неферментирующих бактерий требуется глубокое понимание микробиологических аспектов и антимикробной чувствительности